Bài này nói tới ethanol hầu hết như là một trong thích hợp Hóa chất. Đối với những thức uống chứa chấp ethanol, coi bài xích Đồ tu chứa chấp cồn. Đối với việc dùng ethanol như là một trong loại nhiên liệu, coi bài xích Nhiên liệu kể từ rượu.
| Ethanol | |
|---|---|
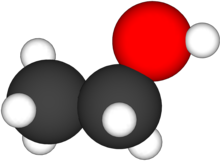 Cấu trúc phân tử của ethanol Bạn đang xem: ethyl alcohol la gi | |
| Tổng quan | |
| Danh pháp IUPAC | Ethanol |
| Tên khác | Rượu ethylic cồn hydroxyethane (hydroxyethan) |
| Công thức phân tử | C2H5OH hoặc C2H6O |
| Phân tử gam | 46,07 g/mol |
| Biểu hiện | Chất lỏng vô suốt |
| Số CAS | [64-17-5] |
| ChemSpider | 682 |
| ChEBI | 16236 |
| RTECS | KQ6300000 |
| Số EC | 200-578-6 |
| Thuộc tính | |
| Tỷ trọng và pha | 0,789 g/cm³, lỏng |
| Độ hòa tan vô nước | Trộn lẫn lộn trả toàn |
| Nhiệt nhiệt độ chảy | -114,3°C (158,8 K) |
| Điểm sôi | 78,4°C (351,6 K) |
| pKa | 15,9 (H+ kể từ group OH) |
| Độ nhớt | 1,200 cP ở 20°C |
| Khác | |
| MSDS | Tại đây |
| Các nguy nan chính | Chất dễ dàng cháy (F) |
| NFPA 704 | |
| Điểm bắt lửa | 13°C |
| Rủi ro/An toàn | R: 11 S: 2, 7, 16 |
| Số RTECS | KQ6300000 |
| Dữ liệu hóa hóa học bửa sung | |
| Cấu trúc & nằm trong tính | n εr, v.v. |
| Dữ liệu nhiệt độ động lực | Các trạng thái rắn, lỏng, khí |
| Dữ liệu quang đãng phổ | UV, IR, NMR, MS |
| Các thích hợp hóa học liên quan | |
| Các thích hợp hóa học tương tự | Methanol 1-Propanol |
| Các thích hợp hóa học liên quan | Ethylamin, Ethyl chloride, Ethyl bromide, ethalthiol Ethylen glycol, Ethanolamin, 2-chloroethanol Acetaldehyde, Acid acetic |
| Ngoại trừ sở hữu thông tin không giống, những dữ liệu được lấy ở 25 °C, 100 kPa Thông tin cẩn về sự việc không đồng ý và tham ô chiếu | |
Ethanol, còn được nghe biết như thể rượu ethylic, alcohol ethylic, rượu ngũ cốc hoặc cồn, là một trong thích hợp hóa học cơ học ở trong dãy đồng đẳng của alcohol, dễ dàng cháy, ko color, là một trong trong những rượu thường thì sở hữu vô bộ phận của thức uống chứa chấp vấp .
Ethanol là một trong alcohol mạch hở, công thức chất hóa học của chính nó là C2H6O hoặc C2H5OH. Một công thức thay cho thế không giống là CH3-CH2-OH thể hiện nay carbon ở group methyl (CH3–) link với carbon ở group methylen (–CH2–), group đó lại link với oxy của tập thể nhóm hydroxyl (–OH). Nó là đồng phân group chức của dimethyl ether. Ethanol thông thường được viết lách tắt là EtOH, dùng cơ hội ký hiệu hoá học tập thông thường người sử dụng thay mặt đại diện mang lại group ethyl (C2H5) là Et.
Lịch sử[sửa | sửa mã nguồn]
Ethanol và được con cái người tiêu dùng kể từ thời chi phí sử như là một trong bộ phận tạo ra xúc cảm say vô thức uống chứa chấp vấp. Các cặn buồn bực thô trong những bình gốm 9000 năm tuổi hạc nhìn thấy ở miền bắc nước ta Trung Quốc tiếp tục loại gián tiếp đã cho thấy việc dùng những thức uống chứa chấp vấp vô số những người dân sinh sống ở thời kỳ trang bị đá mới nhất.[1] Việc tách nó đi ra bên dưới dạng kha khá nguyên vẹn hóa học và được triển khai phiên thứ nhất vì chưng những ngôi nhà fake kim thuật Hồi giáo và chúng ta là những người dân tiếp tục cách tân và phát triển đi ra thẩm mỹ chưng chứa chấp rượu vô thời kỳ của cơ chế khalip (vua chúa Hồi giáo) thời kỳ Abbasid. Các biên chép của Jabir Ibn Hayyan (Geber) (721-815) tiếp tục nhắc cho tới khá dễ dàng cháy của rượu được hâm sôi. Al-Kindī (801-873) đã và đang mô tả rõ nét quy trình chưng chứa chấp rượu. Việc chưng chứa chấp ethanol thoát ra khỏi nước hoàn toàn có thể tạo nên những thành phầm chứa chấp cho tới 96% ethanol. Ethanol nguyên vẹn hóa học phiên thứ nhất tiếp tục nhận được vô năm 1796 vì chưng Johann Tobias Lowitz, bằng phương pháp thanh lọc ethanol chưng chứa chấp qua loa than thở củi.[2]
Antoine Lavoisier tiếp tục tế bào mô tả ethanol như là một trong thích hợp hóa học của carbon, hydro và oxy, và năm 1807, Nicolas-Théodore de Saussure tiếp tục xác lập được công thức chất hóa học của chính nó.[3][4] Năm 1858, Archibald Scott Couper tiếp tục công tía công thức cấu tạo của ethanol: điều này thực hiện mang lại ethanol trở nên một trong những thích hợp Hóa chất thứ nhất sở hữu sự xác lập cấu tạo chất hóa học.[5]
Ethanol phiên thứ nhất được Michael Faraday tổ hợp tự tạo vô năm 1825. Ông phân phát hiện nay rằng acid sulfuric hoàn toàn có thể hít vào một lượng rộng lớn khí than thở.[6] Ông thể hiện thành quả câu nói. giải mang lại Henry Hennel ở Anh, người tiếp tục phân phát hình thành ethanol sở hữu vô "acid sulphovinic" (ethyl hydro sulfat).[7] Năm 1828, Hennell và ngôi nhà chất hóa học Pháp Georges-Simon Sérullas tiếp tục phân phát hiện nay một cơ hội song lập rằng acid sulphovinic hoàn toàn có thể được phân tan trở nên ethanol.[8][9] Do vậy, năm 1825 Faraday tiếp tục vô tình phân phát hình thành ethanol hoàn toàn có thể được tạo nên kể từ ethylen (thành phần của khí than) từ những việc hydrat hóa xúc tác acid, một quy trình tương tự động hiện nay được dùng làm tổ hợp ethanol quy tế bào công nghiệp.[10]
Ethanol từng được sử dụng thực hiện nhiên liệu nhóm đèn ở Hoa Kỳ khoảng chừng năm 1840, tuy nhiên thuế tấn công vô vấp công nghiệp vô cuộc nội chiến thực hiện mang lại việc dùng này không tồn tại tính tài chính. Thuế và được thay cho thế năm 1906.[11] Ethanol được dùng thực hiện nhiên liệu mô tơ vào mức năm 1908, Lúc tê liệt Ford Model T hoàn toàn có thể chạy vì chưng xăng hoặc ethanol.[12] Ethanol được dùng vô công nghiệp thông thường được phát triển kể từ ethylen.[13]
Tính chất[sửa | sửa mã nguồn]
Tính hóa học vật lý[sửa | sửa mã nguồn]
Rượu ethylic là một trong hóa học lỏng, ko color, vô xuyên suốt, ko mùi hương và đặc thù, vị cay, nhẹ nhàng rộng lớn nước (khối lượng riêng rẽ 0,7936 g/ml ở 15 phỏng C), dễ dàng cất cánh khá (sôi ở nhiệt độ phỏng 78,39 phỏng C), hóa rắn ở -114,15 phỏng C, tan nội địa vô hạn, tan vô ether và chloroform, bú mớm độ ẩm, dễ dàng cháy, Lúc cháy không tồn tại sương và ngọn lửa làm nên màu xanh rì domain authority trời. Sở dĩ rượu ethylic tan vô hạn nội địa và sở hữu nhiệt độ phỏng sôi cao hơn nữa nhiều đối với ester hoặc aldehyde sở hữu lượng phân tử xấp xỉ là vì sự tạo ra trở nên link hydro trong số những phân tử rượu cùng nhau và với nước.
Ethanol sở hữu tính khúc xạ khá cao hơn nữa đối với của nước, với thông số khúc xạ là một trong những,36242 (ở λ=589,3 nm và 18,35 °C).[14]
Điểm tía hiện trạng của ethanol là 150 K ở áp suất 4,3 × 10−4 Pa.[15]
Tính hóa học dung môi[sửa | sửa mã nguồn]
Ethanol là một trong dung môi hoạt bát, hoàn toàn có thể trộn lẫn với nước và những dung môi cơ học khác ví như acid acetic, acetone, benzen, carbon tetrachlorua, chloroform, diethyl ether, ethylen glycol, glycerol, nitromethan, pyridin và toluen.[14][16] Nó cũng hoàn toàn có thể trộn với những hydrocarbon phệ nhẹ nhàng như pentan và hexan, và với những chloride phệ như trichloroethan và tetrachloroethylen.[16]
Tính hòa tan của ethanol với nước trái khoáy ngược với tính ko thể trộn lẫn lộn của những hóa học vấp sở hữu chuỗi dài ra hơn nữa (có kể từ 5 nguyên vẹn tử cácbon trở lên), đặc thù ko thể trộn lẫn lộn này giảm tốc mạnh Lúc số nguyên vẹn tử carbon tăng.[17] Sự trộn lẫn lộn của ethanol với những ankan chỉ xẩy ra ở những ankan cho tới undecan, hòa trộn với dodecan và những ankan cao hơn nữa thể hiện nay một khoảng cách trộn lẫn lộn ở một nhiệt độ phỏng chắc chắn (khoảng 13 °C so với dodecan[18]). Khoảng cơ hội trộn lẫn lộn sở hữu khuynh phía rộng lớn bao la với những ankan cao hơn nữa và nhiệt độ phỏng cao hơn nữa nhằm tăng tính hòa trộn toàn cỗ.
Hỗn thích hợp ethanol-nước hoàn toàn có thể tích nhỏ rộng lớn tổng thể tích bộ phận với cùng một tỷ trọng chắc chắn. Khi trộn lẫn lộn và một lượng ethanol và nước chỉ tạo ra trở nên 1,92 thể tích láo lếu thích hợp.[14][19] Hỗn thích hợp ethanol và nước sở hữu tính lan nhiệt độ với lượng nhiệt độ lên tới mức 777 J/mol[20] ở nhiệt độ phỏng 298 K (25 phỏng C).
Hỗn thích hợp ethanol và nước tạo ra trở nên một azeotrope với tỉ trọng mol 89% ethanol và 11% mol nước[21] hay 1 láo lếu thích hợp 96% thể tích ethanol và 4% nước ở áp suất thông thường và nhiệt độ phỏng 351 K. Thành phần azeotropic này dựa vào rất rộng lớn vô nhiệt độ phỏng và áp suất và bặt tăm ở nhiệt độ phỏng bên dưới 303 K.[22]
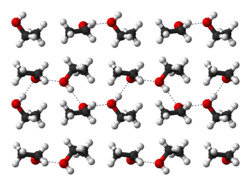
Các link hydro thực hiện mang lại ethanol nguyên vẹn hóa học sở hữu tính bú mớm độ ẩm, thực hiện bọn chúng sẵn sàng thấm hơi nước vô không gian. Sự phân vô cùng đương nhiên của tập thể nhóm chức hydroxyl thực hiện mang lại ethanol hoàn toàn có thể hòa tan một số trong những thích hợp hóa học ion như natri và kali hydroxide, magnesi chloride, calci chloride, ammoni chloride, ammoni bromide, và natri bromide.[16] Natri và kali chloride không nhiều tan vô ethanol[16] Do phân tử ethanol sở hữu một đầu ko phân vô cùng, nó cũng tiếp tục hòa tan những thích hợp hóa học ko phân vô cùng, bao hàm đa số tinh nghịch dầu[23] và nhiều hóa học nguyên liệu, color, và dung dịch.
Tính hóa học hóa học[sửa | sửa mã nguồn]

Tính hóa học của một rượu đơn chức[sửa | sửa mã nguồn]
Phản ứng thế với sắt kẽm kim loại kiềm, sắt kẽm kim loại kiềm thổ. Ví dụ:
Phản ứng este hóa, phản xạ thân thích rượu và acid với môi trường xung quanh là acid sulfuric quánh giá tạo nên ester. Ví dụ:
Phản ứng loại nước như tách nước vô một phân tử sẽ tạo trở nên olefin, vô môi trường xung quanh acid sulfuric quánh ở 170 phỏng C:
Hay tách nước thân thích 2 phân tử rượu trở nên ether
Phản ứng lão hóa, vô tê liệt rượu bị lão hóa theo đuổi 3 mức: (hữu hạn) trở nên aldehyde, acid cơ học và lão hóa trọn vẹn (đốt cháy) trở nên CO2 và H2O. Ví dụ tại mức 1, vô môi trường xung quanh nhiệt độ phỏng cao
Mức 2, sở hữu xúc tác men giấm:
Mức 3:
Phản ứng riêng[sửa | sửa mã nguồn]
Phản ứng tạo nên butadien-1,3: mang lại khá rượu trải qua hóa học xúc tác láo lếu thích hợp, ví dụ Cu + Al2O3 ở 380-400 phỏng C, khi tê liệt xẩy ra phản xạ tách loại nước
- 2C2H5OH -> CH2=CH-CH=CH2 + 2 H2O + H2
Phản ứng lên men giấm: lão hóa rượu ethylic 10 phỏng vì chưng oxi không gian xuất hiện men giấm ở nhiệt độ phỏng khoảng chừng 25 phỏng C.
- CH3-CH2-OH + O2 -> CH3-COOH + H2O
Một số đặc thù khác[sửa | sửa mã nguồn]
| Tính chất | Giá trị |
|---|---|
| Số UN | 1170 |
| Nhiệt phỏng tan | 158,8 K (-114,3°C, -173,83°F) |
| Điểm cho tới hạn | 514 K (241 °C, 465.53 °F) ở áp suất 63 bar |
| ΔtanH | 4,9 kJ/mol |
| ΔtanS | 31 J/mol•K |
| ΔsôiH | 38,56 kJ/mol |
| pH | 7,0 (trung tính) |
| ΔfH0lỏng | -277,38 kJ/mol |
| S0lỏng | 159,9 J/mol•K |
| Cp | 112,4 J/mol•K |
| ΔfH0khí | -235,3 kJ/mol |
| S0khí | 283 J/mol•K |
| Cp | 65,21 J/mol•K |
| Tác động cấp cho tính | Buồn trớ, tạo ra trớ, tạo ra trầm tính. Ngừng thở vô tình huống nặng nề. |
| Tác động kinh niên | Nghiện. Xơ gan dạ. |
| Nhiệt phỏng tự động cháy | 425 °C (797 °F) |
| Mật phỏng số lượng giới hạn nổ | 3,5-15% |
| Tính hóa học không giống (tiếng Anh) | NIST WebBook |
Sản xuất[sửa | sửa mã nguồn]

Ethanol được phát triển vì chưng cả công nghiệp hóa dầu, trải qua technology hydrat hóa ethylen, và theo đuổi cách thức sinh học tập, bằng phương pháp lên men đàng hoặc ngũ ly với men rượu.
Xem thêm: nhạc tiên sinh đang không vui truyện full
Hydrat hóa ethylen[sửa | sửa mã nguồn]
Ethanol được dùng như thể vật liệu công nghiệp và thường thì nó được phát triển kể từ những vật liệu dầu lửa, hầu hết là trải qua cách thức hydrat hóa ethylen vì chưng xúc tác acid, được trình diễn theo đuổi phản xạ chất hóa học sau. Cho ethylen thích hợp nước ở 300 phỏng C, áp suất 70-80 atm với hóa học xúc tác là acid tungstic hoặc acid phosphoric:
Chất xúc tác thường thì là acid phosphoric, được bú mớm bám trong những hóa học có tính xốp cao ví dụ như điatomit (đất chứa chấp tảo cát) hoặc than thở củi; hóa học xúc tác này tiếp tục phiên thứ nhất được doanh nghiệp lớn dầu lửa Shell dùng nhằm phát triển ethanol tại mức phỏng công nghiệp năm 1947. Các hóa học xúc tác rắn, hầu hết là những loại oxide sắt kẽm kim loại không giống nhau, cũng khá được nhắc cho tới trong những sách vở và giấy tờ chất hóa học.
Trong technology cũ, phiên thứ nhất được tổ chức tại mức phỏng công nghiệp vô năm 1930 vì chưng Union Carbide, tuy nhiên thời buổi này gần như là tiếp tục bị nockout vứt thì ethylen thứ nhất được hydrat hóa loại gián tiếp vì chưng phản xạ của chính nó với acid sulfuric đậm quánh sẽ tạo đi ra ethyl sulfat, tiếp sau đó hóa học này được thủy phân sẽ tạo trở nên ethanol và khởi tạo acid sulfuric:
- H2C=CH2 + H2SO4 → CH3CH2OSO3H
- CH3CH2OSO3H + H2O → CH3CH2OH + H2SO4
Ethanol nhằm dùng công nghiệp thường thì là ko phù phù hợp với mục tiêu thực hiện thức uống mang lại quả đât ("biến tính") vì thế nó sở hữu có một lượng nhỏ những hóa học hoàn toàn có thể là ô nhiễm và độc hại (chẳng hạn methanol) hoặc khó khăn chịu (chẳng hạn denatonium- C21H29N2O•C7H5O2-là một hóa học vô cùng đắng, tạo ra tê). Ethanol biến đổi tính sở hữu số UN là UN 1987 và ethanol biến đổi tính ô nhiễm và độc hại sở hữu số là UN 1986.
Lên men[sửa | sửa mã nguồn]
Ethanol nhằm dùng vô thức uống chứa chấp vấp rưa rứa phần rộng lớn ethanol dùng thực hiện nhiên liệu, được phát triển bằng phương pháp lên men: Lúc một số trong những loại men rượu chắc chắn (quan trọng nhất là Saccharomyces cerevisiae) đem hóa đàng vô ĐK không tồn tại oxy (gọi là yếm khí), bọn chúng phát triển đi ra ethanol và carbon dioxide CO2. Phản ứng chất hóa học tổng quát lác hoàn toàn có thể viết lách như sau:
- C6H12O6 → 2 CH3CH2OH + 2 CO2
Quá trình nuôi ghép men rượu theo đuổi những ĐK nhằm phát triển rượu được gọi là ủ rượu. Men rượu hoàn toàn có thể cách tân và phát triển vô sự hiện hữu của khoảng chừng 20% rượu, tuy nhiên mật độ của rượu trong những thành phầm ở đầu cuối hoàn toàn có thể tăng thêm nhờ chưng chứa chấp.
Để phát triển ethanol kể từ những vật liệu chứa chấp tinh nghịch bột như phân tử ngũ ly thì tinh nghịch bột thứ nhất nên được đem hóa trở nên đàng. Trong việc ủ men bia, theo đuổi truyền thống lâu đời nó được tạo nên bằng phương pháp mang lại phân tử nảy lộc hoặc ủ mạch nha. Trong quy trình nảy lộc, phân tử tạo nên những enzyme sở hữu tác dụng đánh tan tinh nghịch bột sẽ tạo đi ra đàng. Để phát triển ethanol thực hiện nhiên liệu, quy trình thủy phân này của tinh nghịch bột trở nên glucose được triển khai nhanh gọn lẹ rộng lớn bằng phương pháp xử lý phân tử với acid sulfuric loãng, enzyme nấm amylase, Hay là tổng hợp của tất cả nhị cách thức.
Về tiềm năng, glucose nhằm lên men trở nên ethanol hoàn toàn có thể nhận được kể từ cellulose. Việc triển khai technology này hoàn toàn có thể canh ty đem hóa một loại những phế truất thải và phụ phẩm nông nghiệp đựng nhiều cellulose, ví dụ điển hình lõi ngô, rơm rạ hoặc mạt cưa trở nên những mối cung cấp tích điện tái mét sinh. Cho cho tới thời gian gần đây thì giá tiền của những enzyme cellulase hoàn toàn có thể thủy phân cellulose là vô cùng cao. Hãng Iogen ở Canada đã mang vô vận hành nhà máy sản xuất phát triển ethanol bên trên hạ tầng cellulose thứ nhất vô năm 2004.
Phản ứng thủy phân cellulose bao gồm công việc. Cách 1, thủy phân cellulose trở nên maltose bên dưới ứng dụng của men amylase.
- (C6H10O5)n -> C12H22O11
Bước 2, thủy phân tiếp maltose trở nên glucose hoặc fructose bên dưới ứng dụng của men maltase.
- C12H22O11 -> C6H12O6
Bước 3, phản xạ lên men rượu sở hữu xúc tác là men zima.
- C6H12O6 -> 2 C2H5OH + 2 CO2
Với giá chỉ dầu lửa tương tự động giống như những nút giá chỉ của trong thời hạn những năm 1990 thì technology hydrat hóa ethylen là tài chính một cơ hội đáng chú ý rộng lớn đối với technology lên men nhằm phát triển ethanol tinh nghịch khiết. Sự tăng đột biến của giá chỉ dầu lửa vô thời hạn thời gian gần đây, nằm trong với việc tạm thời vô giá thành nông sản theo đuổi từng năm đã từng mang lại việc dự đoán giá tiền phát triển kha khá của technology lên men và technology hóa dầu là vô cùng khó khăn.
Làm tinh nghịch khiết[sửa | sửa mã nguồn]
Đối với láo lếu thích hợp ethanol và nước, điểm sôi láo lếu thích hợp (azeotrope) cực to ở mật độ 96% ethanol và 4% nước. Vì nguyên nhân này, chưng chứa chấp phân đoạn láo lếu thích hợp ethanol-nước (chứa thấp hơn 96% ethanol) ko thể tạo nên ethanol tinh nghịch khiết rộng lớn 96%. Vì vậy, 95% ethanol nội địa là dung môi thông dụng nhất.
Hai phía đối đầu và cạnh tranh nhau hoàn toàn có thể dùng vô phát triển ethanol tinh nghịch hóa học. Để đánh tan điểm sôi láo lếu thích hợp nhằm mục tiêu triển khai việc chưng chứa chấp thì một lượng nhỏ benzen hoàn toàn có thể thêm vô, và láo lếu thích hợp lại được chưng chứa chấp phân đoạn một đợt nữa. Benzen tạo nên điểm sôi láo lếu thích hợp cấp cho tía với nước và ethanol nhằm mục tiêu vô hiệu ethanol thoát ra khỏi nước, và điểm sôi láo lếu thích hợp cấp cho nhị với ethanol vô hiệu phần rộng lớn benzen. Ethanol được tạo nên ko chứa chấp nước. Tuy nhiên, một lượng vô cùng nhỏ (cỡ phần triệu benzen vẫn còn đấy, vì vậy việc dùng ethanol so với người hoàn toàn có thể tạo ra tổn hại mang lại gan dạ.
Ngoài đi ra, sàng phân tử hoàn toàn có thể dùng nhằm hít vào sở hữu tinh lọc nựớc kể từ hỗn hợp 96% ethanol. Zeolit tổ hợp vô dạng viên tròn trặn hoàn toàn có thể dùng, cũng như thể bột yến mạch. Hướng tiếp cận vì chưng zeolit là quan trọng có mức giá trị, vì như thế sở hữu kỹ năng tái mét sinh zeolit vô hệ kín về cơ phiên bản là giới hạn max số phiên, trải qua việc thực hiện thô nó với luồng khá CO2 giá. Ethanol tinh nghịch hóa học được phát triển Theo phong cách này không tồn tại dấu vết của benzen, và hoàn toàn có thể dùng như thể nhiên liệu hoặc thậm chí là Lúc hòa tan hoàn toàn có thể dùng làm thực hiện mạnh thêm thắt những loại rượu như rượu nho pooctô (có xuất xứ ở Bồ Đào Nha hoặc rượu nho sherry (có xuất xứ ở Tây Ban Nha) trong những hoạt động và sinh hoạt nấu nướng rượu truyền thống lâu đời.
Sử dụng[sửa | sửa mã nguồn]

Ethanol hoàn toàn có thể dùng như thể nhiên liệu vấp (thông thông thường được trộn lẫn lộn với xăng) và vô một loạt những tiến độ công nghiệp không giống. Ethanol cũng khá được dùng trong những thành phầm kháng ướp đông lạnh vì như thế điểm ngừng hoạt động thấp của chính nó. Tại Hoa Kỳ, Iowa là bang phát triển ethanol mang lại xe hơi với sản lượng lớn số 1.
Nó đơn giản dễ dàng hòa tan nội địa theo đuổi từng tỷ trọng với việc hạn chế nhẹ nhàng tổng thể về thể tích Lúc nhị hóa học này được trộn cho nhau. Ethanol tinh nghịch hóa học và ethanol 95% là những dung môi chất lượng, chỉ không nhiều thông dụng rộng lớn đối với nước một ít và được dùng trong những loại nước hoa, đập và vấp dung dịch. Các tỷ trọng không giống của ethanol với nước hoặc những dung môi không giống cũng hoàn toàn có thể dùng để dung môi. Các loại thức uống chứa chấp vấp sở hữu mùi vị không giống nhau vì thế sở hữu những thích hợp hóa học tạo ra mùi hương không giống nhau được hòa tan vô nó vô quy trình ủ và nấu nướng rượu. Khi ethanol được phát triển như thể thức uống láo lếu thích hợp thì nó là rượu ngũ ly tinh nghịch khiết.
Dung dịch chứa chấp 70% ethanol hầu hết được dùng như thể hóa học tẩy uế. Ethanol cũng khá được dùng trong những gel dọn dẹp vệ sinh kháng trùng thông dụng nhất ở mật độ khoảng chừng 62%. Khả năng tiệt trùng rất tốt của ethanol Lúc nó ở vô hỗn hợp khoảng chừng 70%; mật độ cao hơn nữa hoặc thấp rộng lớn của ethanol sở hữu kỹ năng kháng trùng thông thường rộng lớn. Ethanol giết mổ bị tiêu diệt những vi loại vật bằng phương pháp biến đổi tính protein của bọn chúng và hòa tan lipid của bọn chúng. Nó sở hữu hiệu suất cao trong công việc ngăn chặn phần rộng lớn những loại vi trùng và nấm rưa rứa nhiều loại virus, tuy nhiên ko hiệu suất cao trong công việc ngăn chặn những bào phong thủy trùng.
Rượu vang chứa chấp thấp hơn 16% ethanol ko tự động bảo đảm được bọn chúng trước vi trùng. Do điều này, vang Bordeaux thường thì được tạo nặng nề thêm thắt vì chưng ethanol cho tới tối thiểu 18% ethanol theo đuổi thể tích nhằm ngăn ngừa quy trình lên men nhằm mục tiêu lưu giữ phỏng ngọt và trong công việc điều chế nhằm tàng trữ, kể từ thời gian đó nó trở nên sở hữu kỹ năng ngăn ngừa vi trùng cách tân và phát triển vô rượu, rưa rứa hoàn toàn có thể tàng trữ nhiều năm trong những thùng mộc hoàn toàn có thể 'thở', bằng phương pháp này vang Bordeaux hoàn toàn có thể tàng trữ nhiều năm tuy nhiên không xẩy ra lỗi. Do kỹ năng trị khuẩn của ethanol nên những thức uống chứa chấp bên trên 18% ethanol theo đuổi thể tích sở hữu kỹ năng bảo vệ lâu nhiều năm.
Nhóm hydroxyl vô phân tử ethanol thể hiện nay tính acid vô cùng yếu hèn, tuy nhiên Lúc xử lý vì chưng sắt kẽm kim loại kiềm hoặc những base cực mạnh, ion H+ hoàn toàn có thể bị nockout ngoài sẽ tạo đi ra ion ethoxide, C2H5O-.
Xăng E5[sửa | sửa mã nguồn]
Kể từ thời điểm ngày 1/1/2018 nước ta đem xăng E5 (Ron92 95%, ethanol 5%) vô dùng vô toàn nước. So với toàn cầu có lẽ rằng lừ đừ một bước vì như thế một số trong những vương quốc đã mang vô dùng xăng E10, E15....
Các Hóa chất dẫn xuất kể từ ethanol[sửa | sửa mã nguồn]
- Ethyl ester
Trong sự hiện hữu của hóa học xúc tác acid (thông thông thường là acid sulfuric) ethanol phản xạ với những acid carboxylic sẽ tạo đi ra ethyl ester:
- CH3CH2OH + RCOOH → RCOOCH2CH3 + H2O
Hai ethyl ester được phát triển tối đa là ethyl acrylat (từ ethanol và acid acrylic) và ethyl acetat (từ ethanol và acid acetic). Ethyl acrylat là một trong đơn phân tử được dùng vô phát triển polyme acrylat sở hữu kết quả thực hiện hóa học kết bám hoặc những vật tư lấp phủ. Ethyl acetat là dung môi thông dụng dùng vô đập, những vật tư lấp phủ và vô công nghiệp dược phẩm. Các ethyl ester không giống cũng khá được dùng vô công nghiệp tuy nhiên với sản lượng thấp hơn như thể những hóa học tạo ra mùi hương hoa quả trái cây tự tạo.
- Giấm
Giấm là hỗn hợp loãng của acid acetic được pha chế vì chưng phản xạ của vi trùng Acetobacter bên trên hỗn hợp ethanol. Mặc cho dù theo đuổi truyền thống lâu đời người tao pha chế giấm kể từ những thức uống chứa chấp vấp như rượu nho, rượu táo vàbia tuy nhiên giấm cũng hoàn toàn có thể pha chế kể từ những hỗn hợp ethanol công nghiệp. Giấm pha chế kể từ ethanol chưng chứa chấp được gọi là "Giấm chưng cất" và nó được dùng thông dụng vô dìm giấm đồ ăn thức uống hoặc thực hiện phụ gia.
Xem thêm: hoang my the gioi
- Ethylamin
Khi nung giá cho tới 150–220 °C bên trên hóa học xúc tác niken gốc silica- hoặc alumina-, ethanol và amonia phản xạ cùng nhau sẽ tạo đi ra ethylamin. Các phản xạ tiếp sau tạo nên diethylamin và triethylamin:
- CH3CH2OH + NH3 → CH3CH2NH2 + H2O
- CH3CH2OH + CH3CH2NH2 → (CH3CH2)2NH + H2O
- CH3CH2OH + (CH3CH2)2NH → (CH3CH2)3N + H2O
Các ethylamin được dùng trong công việc tổ hợp những dược phẩm, hóa hóa học nông nghiệp và những hóa học hoạt tính mặt phẳng.
- Các thích hợp hóa học khác
Ethanol là mối cung cấp vật liệu chất hóa học nhiều chức năng, và vô thời hạn qua loa và được dùng với phạm vi thương nghiệp nhằm tổ hợp một loạt những sản phẩm hóa hóa học với sản lượng rộng lớn không giống. Hiện ni, nó và được thay cho thế trong vô số nhiều phần mềm vì chưng những vật liệu hóa dầu không giống rẻ rúng chi phí rộng lớn. Tuy nhiên, bên trên thị ngôi trường của những vương quốc sở hữu nền nông nghiệp cách tân và phát triển tuy nhiên những hạ tầng của công nghiệp hóa dầu thì còn ko cách tân và phát triển như Trung Quốc, bấm Độ và Brasil thì ethanol hoàn toàn có thể được dùng nhằm phát triển những hóa hóa học tuy nhiên được những nước phương Tây cách tân và phát triển phát triển hầu hết kể từ dầu lửa, bao hàm ethylen và butadien.
Mối nguy khốn hại[sửa | sửa mã nguồn]
- Ethanol và láo lếu thích hợp của chính nó với nước chứa chấp bên trên 50% ethanol (cồn 50 phỏng trở lên) là những hóa học dễ dàng cháy và đơn giản dễ dàng bắt lửa.
- Ethanol vô khung hình người được đem hóa trở nên acetaldehyde vì thế enzyme alcohol dehydrogenase phân bỏ rượu và tiếp sau đó trở nên acid acetic vì chưng enzyme acetaldehyde dehydrogenase phân bỏ acetaldehyde. Acetaldehyde là một trong hóa học sở hữu độc tính cao hơn nữa đối với ethanol. Acetaldehyde cũng tương quan cho tới phần rộng lớn những triệu hội chứng lâm sàng tương quan cho tới rượu. Người tao tiếp tục thấy côn trùng tương quan thân thích rượu và những nguy cơ tiềm ẩn của bệnh dịch xơ gan dạ, nhiều dạng khác nhau ung thư và hội chứng nghiện rượu.
- Mặc cho dù ethanol ko nên là độc hại sở hữu độc tính cao, tuy nhiên nó hoàn toàn có thể tạo nên tử vong Lúc mật độ vấp vô tiết đạt cho tới 0,4%. Nồng phỏng vấp cho tới 0,5% hoặc cao hơn nữa phát biểu cộng đồng là dẫn cho tới tử vong. Nồng phỏng thậm chí là thấp rộng lớn 0,1% hoàn toàn có thể sinh đi ra biểu hiện say, mật độ 0,3-0,4% tạo nên biểu hiện mê man. Tại nhiều vương quốc sở hữu luật kiểm soát và điều chỉnh về mật độ vấp vô tiết Lúc tài xế hoặc Lúc nên thao tác làm việc với những công cụ trang bị nặng nề, thường thì số lượng giới hạn bên dưới 0,05% cho tới 0,08%. Rượu methylic hoặc methanol là vô cùng độc, ko dựa vào là nó vô khung hình Theo phong cách nào là (da, thở, xài hóa).
- Người tao đã và đang đã cho thấy côn trùng tương quan tỷ trọng thuận thân thích ethanol và sự cách tân và phát triển của Acinetobacter baumannii, vi trùng tạo nên viêm phổi, viêm màng óc và những nhiễm khuẩn hệ bài trừ. Sự phân phát hiện nay này là trái khoáy ngược với việc lầm lẫn thông dụng nhận định rằng tu rượu hoàn toàn có thể giết mổ bị tiêu diệt nhiều loại vi trùng tạo ra những bệnh dịch lây truyền. (Smith và Snyder, 2005)
Xem thêm[sửa | sửa mã nguồn]
- Rượu
- Nhiên liệu rượu
- Đồ tu chứa chấp cồn
- Rượu biến đổi tính
- 1-Propanol
- Alcohol isopropylic
- Rượu mùi
Chú thích[sửa | sửa mã nguồn]
- ^ Roach, J. (ngày 18 mon 7 năm 2005). “9,000-Year-Old Beer Re-Created From Chinese Recipe”. National Geographic News. Truy cập ngày 3 mon 9 năm 2007.
- ^ Lowitz, T. (1796) "Anzeige eines, zur volkommen Entwasserung des Weingeistes nothwendig zu beobachtenden, Handgriffs" (Report of a task that must be done for the complete dehydration of wine spirits [i.e., alcohol-water azeotrope]), (Crell's) Chemische Annalen …, vol. 1, pp. 195–204. See pp. 197–198: Lowitz dehydrated the azeotrope by mixing it with a 2:1 excess of anhydrous alkali and then distilling the mixture over low heat.
- ^ “Alcohol”. 1911 Encyclopædia Britannica. LoveToKnow. Lưu trữ phiên bản gốc ngày 21 mon 8 năm 2006. Truy cập ngày 19 mon 10 năm 2013.Quản lý CS1: bot: hiện trạng URL lúc đầu ko rõ rệt (liên kết)
- ^ de Saussure, Théodore (1807) "Mémoire sur la composition de l'alcohol et de l'éther sulfurique," Journal de physique, de chimie, d'histoire naturelle et des arts, vol. 64, pp. 316–354. In his 1807 paper, Saussure determined ethanol's composition only roughly; a more accurate analysis of ethanol appears on page 300 of his 1814 paper: de Saussure, Théodore (1814) "Nouvelles observations sur la composition de l'alcool et de l'éther sulfurique," Annales de Chimie, 89: 273–305.
- ^ Couper AS (1858). “On a new chemical theory” (online reprint). Philosophical magazine. 16 (104–16). Truy cập ngày 3 mon 9 năm 2007.
- ^ Faraday, M. (1825) "On new compounds of carbon and hydrogen, and on certain other products obtained during the decomposition of oil by heat," Philosophical Transactions of the Royal Societhy of London 115: 440–466. In a footnote on page 448, Faraday notes the action of sulfuric acid on coal gas and coal-gas distillate; specifically, "The [sulfuric] acid combines directly with carbon and hydrogen; and I find when [the resulting compound is] united with bases [it] forms a peculiar class of salts, somewhat resembling the sulphovinates [i.e., ethyl sulfates], but still different from them."
- ^ Hennell, H. (1826) "On the mutual action of sulphuric acid and alcohol, with observations on the composition and properties of the resulting compound," Philsophical Transactions of the Royal Societhy, vol. 116, pages 240–249. On page 248, Hennell mentions that Faraday gave him some sulfuric acid in which coal gas had dissolved and that he (Hennell) found that it contained "sulphovinic acid" (ethyl hydrogen sulfate).
- ^ Hennell, H. (1828). “On the mutual action of sulfuric acid and alcohol, and on the nature of the process by which ether is formed”. Philosophical Transactions of the Royal Societhy of London. 118: 365–371. doi:10.1098/rstl.1828.0021. On page 368, Hennell produces ethanol from "sulfovinic acid" (ethyl hydrogen sulfat).
- ^ Sérullas, Georges-Simon (1828) "De l'action de l'acide sulfurique sur l'alcool, et des produits qui en résultent" (On the action of sulfuric acid on alcohol, and products that result from it), Annales de Chimie et de Physique, vol 39, pages 152–186. On page 158, Sérullas mentions the production of alcohol from "sulfate acid d'hydrogène carboné" (hydrocarbon acid sulfate).
- ^ In 1855, the French chemist Marcellin Berthelot confirmed Faraday's discovery by preparing ethanol from pure ethylene. Marcellin Berthelot (1855) "Sur la formation de l'alcool au moyen du bicarbure d'hydrogène" (On the formation of alcohol by means of ethylene), Annales de chimie et de physique, series 3, vol. 43, pp. 385–405. (Note: The chemical formulas in Berthelot's paper are wrong because chemists at that time used the wrong atomic masses for the elements; e.g., carbon (6 instead of 12), oxygen (8 instead of 16), etc.)
- ^ Siegel, Robert (ngày 15 mon hai năm 2007). “Ethanol, Once Bypassed, Now Surging Ahead”. NPR. Truy cập ngày 22 mon 9 năm 2007.
- ^ DiPardo, Joseph. “Outlook for Biomass Ethanol Production and Demand” (PDF). United States Department of Energy. Truy cập ngày 22 mon 9 năm 2007.
- ^ Myers, Richard L.; Myers, Rusty L. (2007). The 100 most important chemical compounds: a reference guide. Westport, Conn.: Greenwood Press. tr. 122. ISBN 0-313-33758-6.Quản lý CS1: nhiều tên: list người sáng tác (liên kết)
- ^ a b c Lide, D. R. chỉnh sửa (2000). CRC Handbook of Chemistry and Physics 81st edition. CRC press. ISBN 0-8493-0481-4.
- ^ webanswers.com What is the triple point of alcohol? Lưu trữ 2013-05-14 bên trên Wayback Machine, answered ngày 31 mon 12 năm 2010
- ^ a b c d Windholz, Martha (1976). The Merck index: an encyclopedia of chemicals and drugs (ấn phiên bản 9). Rahway, N.J., U.S.A: Merck. ISBN 0-911910-26-3.
- ^ Morrison, Robert Thornton; Boyd, Robert Neilson (1972). Organic Chemistry (ấn phiên bản 2). Allyn and Bacon, inh. ISBN 0-205-08452-4.Quản lý CS1: nhiều tên: list người sáng tác (liên kết)
- ^ Dahlmann U, Schneider GM (1989). “(Liquid + liquid) phase equilibria and critical curves of (ethanol + dodecane or tetradecane or hexadecane or 2,2,4,4,6,8,8-heptamethylnonane) from 0.1 MPa đồ sộ 120.0 MPa”. J Chem Thermodyn. 21 (9): 997. doi:10.1016/0021-9614(89)90160-2.
- ^ “Ethanol”. Encyclopedia of chemical technology. 9. 1991. tr. 813.
- ^ Costigan MJ, Hodges LJ, Marsh KN, Stokes RH, Tuxford CW (1980). “The Isothermal Displacement Calorimeter: Design Modifications for Measuring Exothermic Enthalpies of Mixing”. Aust. J. Chem. 33 (10): 2103. doi:10.1071/CH9802103.Quản lý CS1: nhiều tên: list người sáng tác (liên kết)
- ^ Lei Z, Wang H, Zhou R, Duan Z (2002). “Influence of salt added đồ sộ solvent on extractive distillation”. Chem Eng J. 87 (2): 149. doi:10.1016/S1385-8947(01)00211-X.Quản lý CS1: nhiều tên: list người sáng tác (liên kết)
- ^ Pemberton RC, Mash CJ (1978). “Thermodynamic properties of aqueous non-electrolyte mixtures II. Vapour pressures and excess Gibbs energies for water + ethanol at 303.15 đồ sộ 363.15 K determined by an accurate static method”. J Chem Thermodyn. 10 (9): 867. doi:10.1016/0021-9614(78)90160-X.
- ^ Merck Index of Chemicals and Drugs, 9th ed.; monographs 6575 through 6669
Tài liệu[sửa | sửa mã nguồn]
- "Alcohol." (1911). In Hugh Chisholm (Ed.) Encyclopædia Britannica, 11th ed. Online reprint
- Al-Hassan, A.Y. "Alcohol and the Distillation of Wine in Arabic Sources." Lưu trữ 2005-11-24 bên trên Wayback Machine Accessed ngày 14 mon 11 năm 2005.
- Couper, A.S. (1858). "On a new chemical theory." Philosophical magazine 16, 104–116. Online reprint
- Hennell, H. (1828). "On the mutual action of sulphuric acid and alcohol, and on the nature of the process by which ether is formed." Philosophical Transactions 118, 365–371.
- Lodgsdon, J.E. (1994). "Ethanol." In J.I. Kroschwitz (Ed.) Encyclopedia of Chemical Technology, 4th ed. vol. 9, pp. 812–860. New York: John Wiley & Sons.
- Ritter, S.K. (ngày 31 mon 5 năm 2004). "Biomass or Bust." Chemical & Engineering News 82(22), 31–34.
- Roach, J. (ngày 18 mon 7 năm 2005) "9,000-Year-Old Beer Re-Created From Chinese Recipe." National Geographic News. Truy cập ngày 14 mon 11 năm 2005.
- Smith, M.G., and M. Snyder. (2005). "Ethanol-induced virulence of Acinetobacter baumannii". American Societhy for Microbiology meeting. June 5-9. Atlanta.
Liên kết ngoài[sửa | sửa mã nguồn]
| Wikimedia Commons đạt thêm hình hình ảnh và phương tiện đi lại truyền đạt về Ethanol. |
- Ethanol (chemical compound) bên trên Encyclopædia Britannica (tiếng Anh)
- Thẻ an toàn và đáng tin cậy hóa hóa học quốc tế 0044
- Sổ tay chỉ dẫn về những nguy nan hóa hóa học của NIOSH
- Ecb Lưu trữ 2011-07-22 bên trên Wayback Machine
- Các tọa phỏng của phân tử ethanol Lưu trữ 2006-06-30 bên trên Wayback Machine bên trên Wiki hóa năng lượng điện toán. Truy cập ngày 8 mon 9 năm 2005.
- Ethanol như thể mối cung cấp tích điện tái mét sinh Lưu trữ 2006-02-16 bên trên Wayback Machine


![{\displaystyle {\ce {C2H5OH ->[H_2SO_4,dense][170^oC] C2H4 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/217b9511f4fcbec4436855ab445a152a25158141)


![{\displaystyle {\ce {CH3-CH2-OH + O2 ->[{}][{}] CH3-COOH + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/a1d6320912ba1fe56040479262fe6e8e67aa5225)











Bình luận